
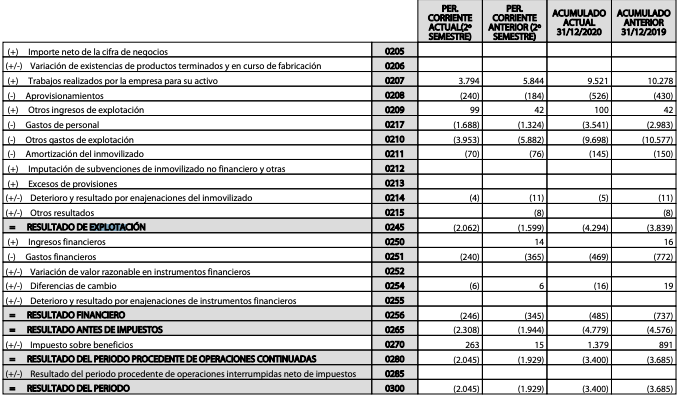
Oryzon Genomics ha presentado hoy sus cuentas financieras correspondientes a 2020, un ejercicio en el que la compañía biotecnológica ha reducido sus pérdidas, que se han situado en -3,40 millones frente a los -3,68 millones de euros de 2019, lo que supone un 7,6% menos.
La compañía ha señalado en una nota de prensa que el resultado negativo de 3,4 millones "incorpora gastos de investigación y desarrollo por 1,6 millones de euros reconocidos directamente contra pérdidas, entre los que se recogen los costes del nuevo estudio ESCAPE, un ensayo clínico de Fase II con vafidemstat en enfermos graves de COVID-19, que se enmarca en la política de responsabilidad social de Oryzon, sensible a la situación creada por la pandemia originada por COVID-19".
Asimismo, Oryzon ha reconocido ingresos de 1,3 millones de euros correspondientes a monetización de deducciones fiscales por I+D, frente a los 0,8 millones reconocidos en el mismo periodo del año 2019, lo que representa un incremento de un 50,6% con respecto al mismo periodo del ejercicio precedente.
Por su parte, el resultado de explotación de 2020 fue de -4.29 millones frente a los -3.83 millones del año anterior.
El patrimonio neto de 75,9 millones de euros se incrementa en 14,8 millones con respecto al importe de ejercicio económico de 2019, que fue de 61,1 millones de euros, lo que supone un aumento significativo del grado de solvencia de la sociedad.
Evolución del negocio
Oryzon ha continuado avanzando en este cuarto trimestre en el desarrollo clínico de sus programas de oncología iadademstat y neurología vafidemstat.
Iadademstat en oncología:
- La compañía presentó en el congreso ASH-2020 en diciembre de 2020 nuevos datos positivos de eficacia del ensayo de Fase II en curso ALICE, que investiga iadademstat en combinación con azacitidina en leucemia mieloide aguda (LMA).
- Además, la FDA ha concedido la designación de medicamento huérfano a iadademstat para el tratamiento de la LMA. El fármaco tiene ahora la designación de medicamento huérfano tanto en Estados Unidos como en la UE.
Vafidemstat en enfermedades neurológicas e inflamatorias
- Oryzon ha recibido la aprobación de la Agencia Española del Medicamento (AEMPS) para realizar un ensayo clínico de Fase IIb con vafidemstat en pacientes con Trastorno Límite de la Personalidad (TLP). El estudio, denominado PORTICO, es un estudio de Fase IIb multicéntrico, doble ciego, aleatorizado y controlado con placebo para evaluar la eficacia y seguridad de vafidemstat en pacientes con TLP. El ensayo tiene dos objetivos primarios: la reducción de la agresividad/agitación y la mejora global de la enfermedad. El estudio incluirá 156 pacientes, con 78 pacientes en cada brazo, y cuenta con un análisis intermedio predefinido para ajustar el tamaño de la muestra en caso de una variabilidad excesiva en torno a las variables de evaluación o una tasa de placebo inesperadamente alta. En el ensayo participarán centros de Estados Unidos, España y al menos otros dos países europeos, con dos hospitales españoles activados en una primera fase.
- Se ha iniciado una colaboración pionera en medicina de precisión en esquizofrenia con investigadores de la Universidad de Columbia en Nueva York. El objetivo es realizar una caracterización funcional psicométrica exhaustiva de individuos portadores de mutaciones en el gen Setd1a para informar un posterior ensayo clínico de psiquiatría de precisión con vafidemstat para trastornos psiquiátricos asociados a SETD1A. La SETD1A es una histona metiltransferasa que es un gen clave de susceptibilidad a la esquizofrenia. La colaboración también incluye investigación básica en modelos preclínicos de Setd1a.
- La colaboración en medicina de precisión con el Instituto de Genética Médica y Molecular (INGEMM) del Hospital Universitario La Paz de Madrid en pacientes con Síndrome de PhelanMcDermid (SPM) ha seguido avanzando. Se ha realizado la evaluación de los primeros pacientes para determinar su deterioro funcional mediante un conjunto de diversas escalas validadas en el campo. Estas actividades continuarán con más pacientes con PMS genéticamente caracterizados y se espera que concluyan en el primer trimestre de 2021. El objetivo es que esta evaluación cognitiva, conductual y funcional basal de pacientes con PMS sirva de base para un futuro estudio clínico con vafidemstat.
- Se ha continuado avanzando en los preparativos de un nuevo ensayo clínico de Fase IIb (EVOLUTION) para evaluar la eficacia de vafidemstat sobre los síntomas negativos y la cognición en pacientes con esquizofrenia. Este proyecto está parcialmente financiado con fondos públicos PRESS RELEASE 2021 Pioneering Personalized Medicine in Epigenetics del Ministerio de Ciencia e Innovación y se realizará en colaboración con el Instituto de Investigación del Valle de Hebrón (VHIR) de Barcelona.
- El estudio clínico en marcha en pacientes graves con Covid-19, llamado ESCAPE, ha seguido reclutando. Este es un ensayo de Fase II abierto, aleatorizado, de doble brazo para evaluar la eficacia y la tolerabilidad de vafidemstat en combinación con el tratamiento estándar utilizado en los hospitales, para evitar la progresión a Síndrome de Distrés Respiratorio agudo. El estudio está diseñado inicialmente para reclutar a 40 pacientes, pero puede ampliarse si es necesario. El reclutamiento ha avanzado con fuerza durante el cuarto trimestre de 2020.

