“Más vale tarde que nunca”, dice el dicho y así ha sido para Novavaxy su vacuna contra el covid-19. La firma está más cerca de recibir la autorización de la Administración de Drogas y Alimentos o FDA tras resolver los problemas de fabricación, según Joseph Walker en The Wall Street Journal.
“La autorización en los EE. UU. no es inminente porque la Administración de Drogas y Alimentos debe clasificar una gran cantidad de datos de estudios de varios países”, dijo una persona familiarizada con el asunto. Sin embargo, se está acercando una decisión, ya que Novavax presentó formalmente una solicitud de autorización a fines de enero.
“Si la vacuna se implementa en los EE. UU., podría impulsar los esfuerzos de vacunación que han decaído”, según Novavax y los médicos.
¿En qué se diferencia esta vacuna?
A diferencia de las vacunas de ARN mensajero de vanguardia de Pfizer y Moderna, la inyección de Novavax utiliza una tecnología familiar, utilizada durante décadas para inocular a los bebés contra la hepatitis B, que algunas personas indecisas podrían encontrar más atractiva. Algunas personas también se han preocupado por la rapidez con que se desarrollaron las inyecciones de ARNm y la falta de datos a largo plazo.
“Es importante ofrecer opciones”, dijo Carina Rodríguez, jefa de enfermedades infecciosas de la Universidad del Sur de Florida. "Tal vez no elimine por completo el problema de la vacilación de la vacuna, pero ayudará a las personas que no se sienten cómodas con una vacuna de ARNm".
Los esfuerzos de Novavax
Novavax, de Gaithersburg, Maryland, surgió a principios de 2020 como un candidato inesperado en la carrera por fabricar una vacuna contra el covid-19. En julio de 2020, EE. UU. otorgó a la empresa un contrato de 1.600 millones de dólares para desarrollar y entregar 100 millones de dosis de su vacuna candidata.
“Sin embargo, Novavax luchó para igualar el ritmo de Pfizer, más grande y con más experiencia, y Moderna, más rica en biotecnología”, dijo Roger Song, analista de biotecnología de Jefferies. “Todos los jugadores principales estaban mucho mejor financiados. Novavax era un desvalido y no tenía el capital para hacer esto".
Novavax tuvo que expandir su fuerza laboral rápidamente y encontrar socios para aumentar su capacidad de fabricación. A fines de 2020, había cuadriplicado su fuerza laboral a alrededor de 690, luego la duplicó el año pasado a más de 1.500 empleados.
“Los mayores desafíos de Novavax fueron mostrarle a la FDA que podía fabricar su vacuna de manera confiable y consistente a gran escala”, dijo el director médico de Novavax, Filip Dubovsky.
¿Cómo funciona la vacuna?
El pinchazo de Novavax, conocido como vacuna de proteína recombinante, administra directamente una versión de la proteína de punta que el coronavirus usa para infectar células humanas, entrenando al sistema inmunológico para combatir el virus. (Por el contrario, las vacunas de ARNm entregan el material genético que el cuerpo usa para fabricar la proteína de pico para desencadenar la misma respuesta inmune).
La inyección incluye un llamado adyuvante, un ingrediente que a veces se usa en las vacunas para estimular una respuesta inmunitaria. La de Novavax es una sustancia llamada Matrix-M, derivada de la corteza de un árbol originario de Chile.
Para obtener la autorización de la FDA, Novavax tuvo que demostrar que su proteína espiga y su adyuvante eran los mismos en todos los lotes de fabricación. “El proceso tomó más tiempo de lo esperado, pero Novavax pudo resolverlo”, dijo Dubovsky.“Es por eso que nos retrasamos en comparación con algunas de las otras plataformas. Porque fue más difícil convencer a las agencias reguladoras de que lo habíamos resuelto”.
“La extensa red de fabricación de Novavax complicó aún más el proceso”, dijo Silvia Taylor, vicepresidenta sénior de asuntos corporativos globales de Novavax, en una entrevista. Inicialmente, la compañía confía en el Serum Institute of India para fabricar la porción de proteína de pico de la vacuna y para completar el embotellado de la vacuna.
“La FDA tenía la intención de asegurarse de que la fabricación de Novavax cumpliera con los estándares estadounidenses”, dijo una persona familiarizada con el asunto, después de que millones de dosis de vacunas de Johnson & Johnson se arruinaron en 2021 debido a problemas de control de calidad en su fabricante contratado Emergent BioSolutions Inc. en Baltimore.
“Sin embargo, los protocolos de seguridad pandémicos dificultaron que los inspectores de la FDA llegaran a los sitios de fabricación en el extranjero de Novavax”, señaló la persona.
La vacuna de Novavax tuvo una protección del 90% contra la infección sintomática y del 100% contra la enfermedad grave en un gran ensayo de fase 3 realizado en los EE. UU. y México. También parece tener tasas más bajas de efectos secundarios, como dolor de cabeza y fatiga, que las vacunas de ARNm, según los médicos.
Novavax dijo que su vacuna pierde parte de su potencia contra la variante Omicron después de dos dosis, pero que una tercera inyección de refuerzo debería brindar una fuerte protección. La compañía también está trabajando en una vacuna específica de Omicron, pero dijo que aún no está segura de si será necesaria.
Países que apoyan a Novavax
Los funcionarios de salud en Europa, Australia y otros lugares han autorizado su uso en los últimos meses. Algunos, incluidos Canadá y Corea del Sur, lo han promovido activamente como una alternativa a las inyecciones de ARNm para las personas que no han sido vacunadas o reforzadas.
Australia dijo recientemente que permitiría que las personas para quienes las vacunas de ARNm no son adecuadas usen la vacuna Novavax como refuerzo, pero actualmente recomienda las vacunas Pfizer o Moderna para todas las personas mayores de 18 años. Los médicos interpretaron la recomendación como una forma de hacer que la vacuna Novavax disponible para las personas que no quieren ser reforzadas con una vacuna de ARNm.
“La FDA revisará la solicitud de Novavax tan pronto como sea posible", dijo una portavoz de la FDA. “La agencia planea realizar una audiencia del comité asesor antes de tomar una decisión sobre la autorización de la vacuna de Novavax”. No se ha programado una fecha.
Alrededor del 75% de los adultos de EE. UU. estaban completamente vacunados a principios de marzo, frente al 61% en agosto, según los Centros para el Control y la Prevención de Enfermedades.
El porcentaje de adultos que dijeron que “definitivamente no” se vacunarían o “solo si es necesario” aumentó del 16 % en septiembre al 19 % en febrero, según una encuesta de opinión realizada por Kaiser Family Foundation. El porcentaje que dice que "esperará y verá" fue del 4%, frente al 7% de septiembre.
“Todos los días me sorprende la cantidad de personas que se comunican con nosotros y nos dicen: ‘Estoy esperando su vacuna'”, dijo Taylor de Novavax.
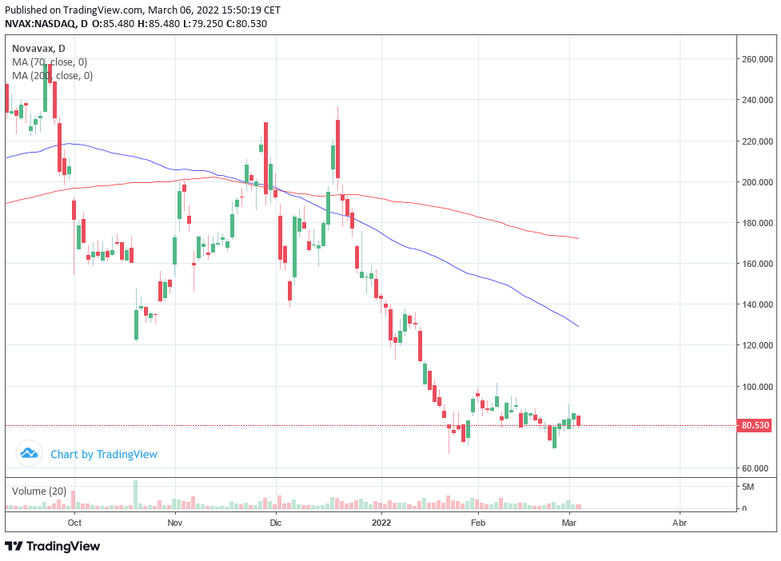
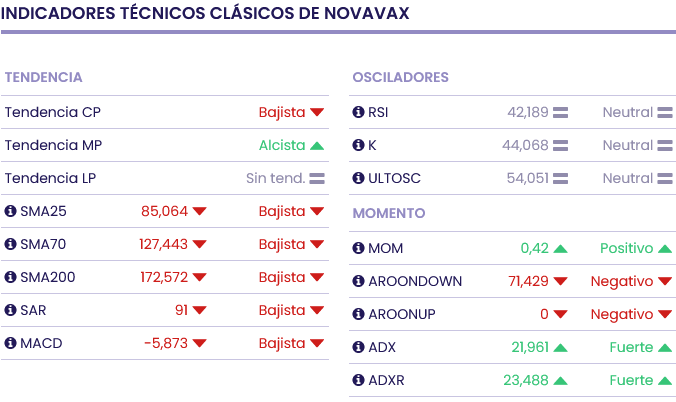
Novavax cerraba la sesión del viernes en los 71.72 dólares y la ubicación de las medias móviles, la de 70 periodos por debajo de la de 200 periodos, nos daría una señal bajista. Mientras, la mayoría de indicadores de Ei se muestran bajistas.

